Cell Metabolism:伴随人类衰老的大脑有氧糖酵解的损伤
随年龄增长大脑会出现全脑代谢降低的情况,但这是否影响脑代谢的形态是未知的。来自华盛顿大学医学院的Manu S. Goyal 等人所在的研究团队基于PET技术测量了从20岁到83岁的认知正常的成年人的大脑葡萄糖摄取,耗氧量和血流量。这篇发表在Cell Metabolism期刊上的研究发现了年龄相关的脑葡萄糖摄取量的减少超过氧气利用率的下降,导致了大脑有氧糖酵解(AG,aerobic glycolysis)的丧失。而在总脑葡萄糖摄取,氧气利用和血流量的形态随年龄保持稳定的基础上,大脑有氧糖酵解的形态变化非常显著,在较年轻的成年人大脑中显示出高有氧糖酵解的脑区随年龄增长发生的变化尤其显著,这说明老化的人类大脑经历了特征性代谢变化,即大脑有氧糖酵解的全脑损失和形态变化。
人类大脑新陈代谢的独特之处在于高度依赖葡萄糖的摄取,尽管大脑仅占标准体重的的2%左右,但其对葡萄糖的摄取占总体葡萄糖消耗率的20%-25%,这种过量的葡萄糖消耗被称为“有氧糖酵解”(AG,aerobic glycolysis),即葡萄糖的非氧化代谢。最近的研究表明,大脑AG可能与突触可塑性和学习尤其相关。在进化过程中,与其他物种相比人类的发育过程被延长和加强,尤其体现在大脑突触可塑性,髓鞘化以及其他脑发育的延长。在之前的研究中已经确定了人类大脑区域之间的转录性早熟的相对差异,此外AG作为大脑发育的代谢特征也与转录性早熟高度相关。因此提出以下假设:
作为正常衰老过程的一部分,例如突触可塑性和髓鞘形成的降低导致的大脑神经过程的减弱,会造成AG的降低,从而可以将AG作为老化人脑中代谢变化的主要特征。
影像分析
将PET扫描像彼此配准后再配准到各自的MRI影像上,而MRI反配准到Talairach标准空间里,然后将PET图像模糊并重新采样到标准空间。配准和相应的转换过程通过软件进行。使用图谱衍生的模板将每个被试的CMRGlc,CBV,CBF和CMRO2图像缩放。
FreeSurfer分析
使用FreeSurfer软件将MRI影像分割为皮层和皮下,灰质,白质和感兴趣区域,ROI用于PET参数的区域估计。
部分体积校正
基于FreeSurfer定义的ROI对PET数据使用区域扩散函数法进行基于MR的部分体积校正。
代谢指标选择
1)OGI指数(氧/葡萄糖):体素级CMRO2/CMRGlc
2)AG:AG = CMRGlc – CMRO2/6
3)GI:CMRGlc空间回归CMRO2后所得残差。
这三个指标高度相关,但是由于OGI在低CMRGlc的区域噪声较大,而GI无法解释,因此区别于传统方法中使用OGI,本文的后续研究将AG值作有氧糖酵解的主要指标,并且当增加有氧糖酵解时,具有更大的直观吸引力。
为了验证本文提出的假设,首先对前人研究中报道的全脑代谢率进行meta-analysis,包括成年人整个寿命周期里随时间变化的葡萄糖摄取量(CMRGlc), 耗氧量(CMRO2), 以及血流量(CBF) 。然后使用PET获取205名20-82岁成年人的大脑局部葡萄糖摄取量(CMRGlc), 耗氧量(CMRO2), 以及血流量(CBF),并进行了后续分析。
1. 全脑AG随年龄增长呈下降趋势
对CMRGlc, CMRO2, and CBF的meta-analysis结果发现这些指标在童年时期呈增加趋势,而在成年后的早期阶段呈下降趋势,随后CMRGlc 继续下降,而CMRO2和CBF 保持恒定水平。而本文中定义的AG指标随年龄增加而减少,并在60岁时趋近于0(图1)。
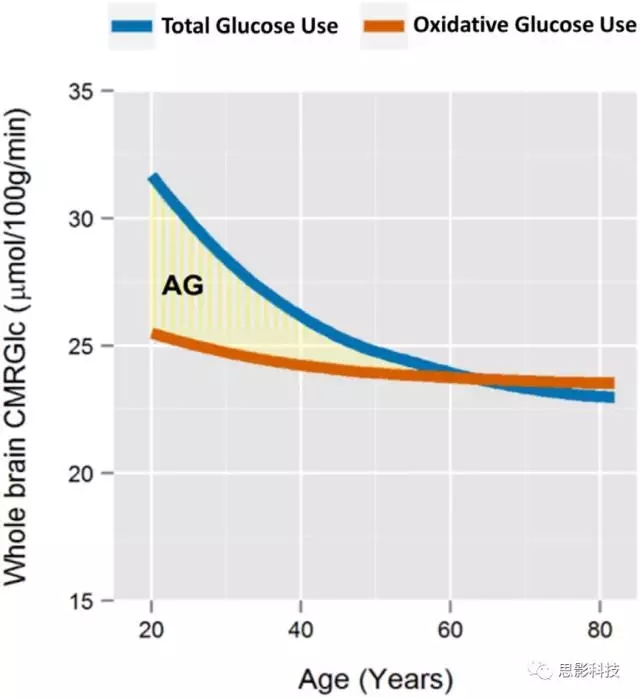
2. 脑代谢变化与年龄有关
首先对每个代谢参数(CMRGlc,CMRO2,CBF和AG)所有被试的测量值进行分位数归一化,这改变了独立数据点的绝对定量值,保留了脑代谢形态的个体差异,还有效地消除由PET扫描仪或研究类型之间的差异引起的统计分布(例如平均值和SD)的差异。然后将主成分分析和多维尺度应用于归一化数据。被试年龄与第一主成分(PC1)相关,表明脑代谢的形态的变化与年龄显著相关(PC1,r = 0.56,p <2*10-16; PC2,r = 0.11 ,p = 0.14)。被试的性别也与第一主成分相关(女性与男性PC1,t =-2.75,p <0.007; PC2,t = 0.93,p = 0.35)。
3. AG对大脑代谢中大量老化相关的形态变化的研究
通过评估被试与基线(来自20-23岁被试的平均结果)大脑代谢参数随年龄增长的相关变化发现,CMRGlc,CMRO2和CBF在整个年龄段中与基线的相关性都很高(CMRGlc minSpearman'srho = 0.92,CMRO2 minrho = 0.89,CBF min rho = 0.91),而AG随着年龄的增长发生了明显的变化(Pearson's r = -0.64,p <2 *10-16)(图2)。多变量分析也证实了大脑代谢形态随年龄变化的主要变量为AG(多变量一般线性模型,AG,p <2 *10-16; CBF,p = 0.0002 ; CMRGlc,p <0.00001; CMRO2,p = 0.07)。这些结果表明CMRGlc,CMRO2和CBF在正常衰老期间保持相对稳定,但AG随年龄的变化很大,但是AG这种代谢形态并没有完全丧失,因为大多数老年被试脑代谢的形态与年轻被试仍然相似。
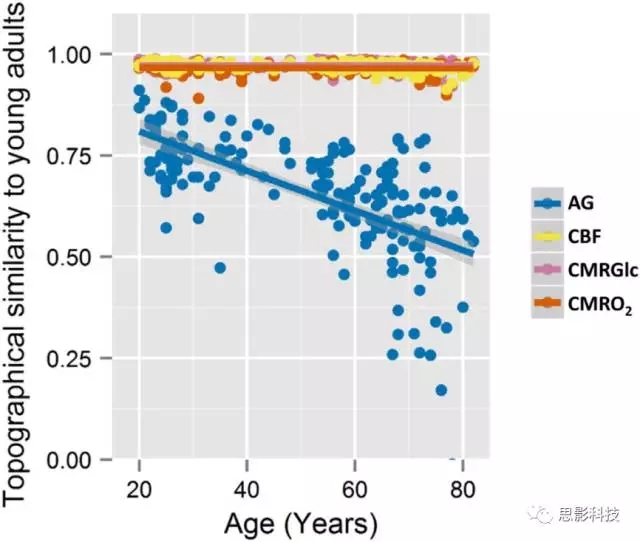
此外,还研究了AG代谢随年龄增长发生变化的其他原因,通过计算每个脑区的糖酵解指数(GI=CMRGlc空间回归CMRO2后的残差,表示CMRGlc和CMRO2的线性相异性),结果发现GI随年龄增长显着降低(Pearson's r = -0.20,p <0.006)。这些结果说明大脑AG的变化可能是全脑AG的量化差异以及CMRGlc和CMRO2之间关系的变化的共同结果。
4. 大脑代谢的局部变化
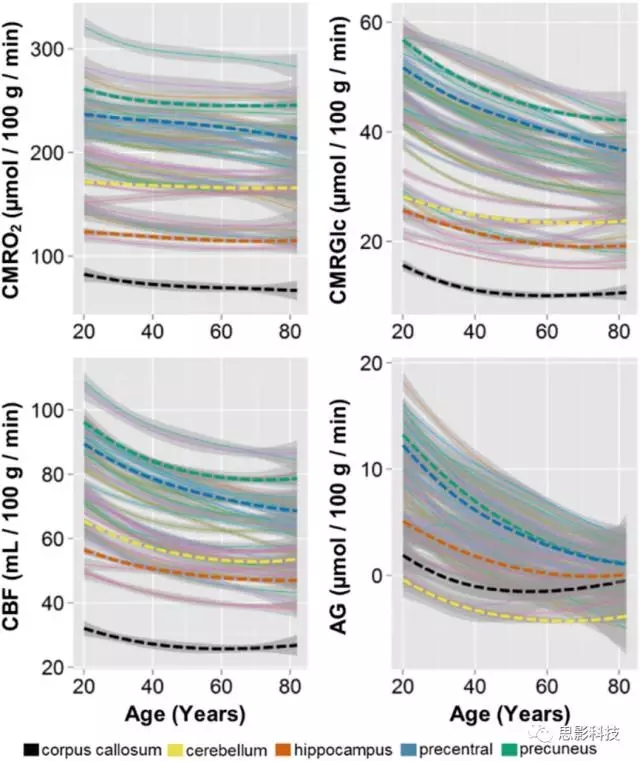
由于对AG年龄相关的变化的全脑组平均分析掩盖了脑区的局部变化,为了评估大脑代谢年龄相关的区域差异,采集了205名认知正常的成年人的PET成像数据,并计算其CMRGlc,CMRO2,CBF和脑血容量,以及用于图像配准和部分体积校正的MRI影像。 PET的脑代谢的精确定量通常需要侵入性估计动脉输入功能,由于本文的研究目标是群体平均区域差异和个体间变化,因此将基于先验的估计与局部到全脑比例结合的方式来确定脑代谢参数的区域量值。具体地,计算了79个灰质和白质脑区域的CMRGlc,CMRO2和CBF的局部-全脑比例,结合基于文献的年龄特异性全脑估计,以得出每个区域的代谢参数的定量值,然后计算区域AG。
图3展示了几个局部脑区大脑代谢参数随年龄的变化轨迹,阴影灰色区域表示黄土曲线的SE,尽管使用基于文献的全脑估计将必然掩盖个体间定量的差异,但除了少数例外所有脑区的四类代谢都有所减少,尤其是AG的下降非常显著。
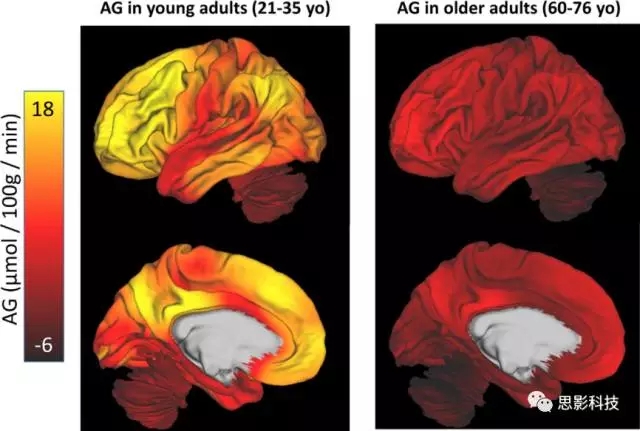
此外,对性别匹配的年轻人(21-35岁)和老年人(60-76岁)脑区AG值分布的比较也发现了一些差异(图4):除AG量化的总体减少之外,老年人AG值在全脑分布呈“扁平化”,而年轻人不同脑区AG值明显差异。
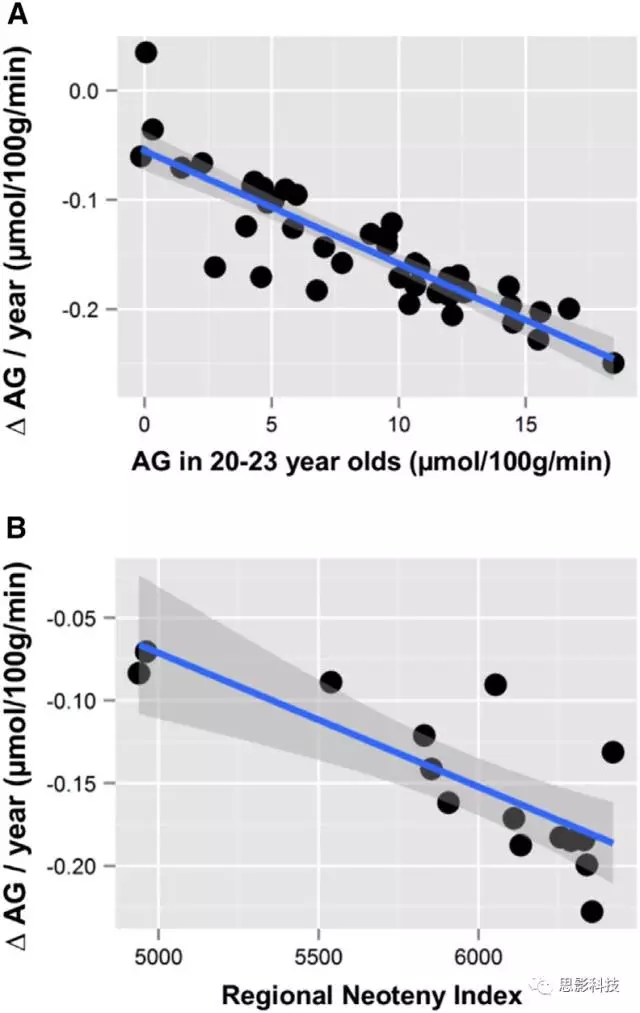
由此假设特定脑区老龄化相关的变化程度与年轻时脑区的AG有关:在皮层和皮下的灰质区域和小脑中,AG随年龄的变化与年轻时对应区域的AG值高度相关(20-23岁年轻人的脑区AG值与该脑区AG变化的斜率,Pearson's r = -0.87,p <3×10-14)(图5A)。此外,结合前人研究结果中成年期间具有高AG的区域与转录新生相关,在这些区域中AG值最年龄的下降也与转录新生相关(区域新生指数与AG变化斜率相关),Pearson's r = -0.79,p <0.0005)(图5B)。这些结果表明,AG随年龄增长的损失主要发生在人类大脑早期发育最快的脑区。
总结
尽管脑AG对不同代谢途径的分配可能是复杂的并且需要进一步的研究,但其随着年龄增长的减少可能由于随着年龄增长大脑突触和髓磷脂的减少。目前尚不清楚皮质髓鞘形成的随年龄增长在相关脑区的变化是否符合文本确定的脑AG的脑区变化,但是从人类连接组项目的寿命延长的新方法和数据可以直接测试这一假设。AG的损失也可能通过戊糖磷酸途径抑制氧化应激的神经保护作用,增加氧化损伤的风险。大脑的许多老化相关的病症与氧化应激相关,包括神经变性疾病如帕金森病和阿尔茨海默病。AG相关的神经保护通常可以抵抗脑中突触可塑性的潜在成本,但在老化的脑中,这种神经保护作用的丧失可能导致活性氧物质的高度损伤。若为真,则可以预测人类大脑的新生区域,即初始高脑AG的区域将特别容易受到这种形式的损害,可能解释了晚期发展脑区与其神经退行性之间的关系。
综合本文的研究结果,脑AG及其初始形态随着大脑的正常老化逐渐减弱,而且这些变化发生在没有淀粉样蛋白病理学或脑部病理学的情况下,表明它们代表正常脑代谢老化的“基线模式”,因此可以将AG作为人类脑力衰老的一种生物标记物。
参考文献:Goyal M S, Vlassenko A G, Blazey T M, et al.Loss of Brain Aerobic Glycolysis in Normal Human Aging[J]. Cell Metabolism,2017, 26(2): 353-360. e3.
From思影科技


