Science:科学家首次发现抗癌药被肿瘤内细菌吃了
作为「癌中之王」,胰腺癌令人闻风丧胆。
近日,来自全球十大科研机构之一魏兹曼研究所的Ravid Straussman教授及其领导的团队联合哈佛大学、麻省理工学院、剑桥大学等机构的研究者共同发现,胰腺癌组织内存在细菌,而且这些细菌居然还一味地护着肿瘤,不但不招来免疫细胞诛杀癌细胞,反而助纣为虐地帮助癌组织「吃掉」常用化疗药物吉西他滨。只要特定微生物是癌细胞的座上宾,研究人员使用10倍于正常浓度的吉西他滨,也伤不得癌细胞分毫。Straussman教授团队的这一重要发现刊登在顶级期刊《科学》杂志上[1]。

Ravid Straussman教授
胰腺癌,其自身可分泌胰蛋白酶分解组织促进转移,又因胰腺的解剖部位较为隐蔽,许多胰腺癌患者确诊时已属晚期,故预后极差,中位生存期只有3-6个月,5年生存率在5%以下[2,3]。
作为胰腺癌治疗的金标准,在吉西他滨(核苷酸类似物)问世以后改善了胰腺癌治疗的有效率,提高了患者的生存质量,但是,应用十几年来,大部分胰腺癌患者仍会表现出对吉西他滨的耐药,最终导致治疗失败[4]。胰腺癌对于吉西他滨耐药的机制,一直以来也是科学家和临床工作者研究的重点。
研究人员曾经认为,肿瘤周围的非癌组织会分泌一些物质,保护肿瘤组织不受药物的伤害,例如肿瘤周围的成纤维细胞分泌的肝细胞生长因子(HGF)等[5,6]。
2012年,Straussman教授团队也想研究健康组织对胰腺癌耐吉西他滨的影响。于是他们找了一大堆健康的组织,与胰腺癌细胞一起培养,再使用吉西他滨处理,看看哪种组织会帮胰腺癌挡子弹。
出乎意料的是,他们发现一块儿来自某个女性的皮肤组织,似乎有超乎寻常的神力。当这个皮肤细胞的细胞株与胰腺癌细胞一起培养的时候,使用10倍于正常剂量的吉西他滨也伤不到胰腺癌细胞。而且,这个皮肤细胞株的培养液也具备这种功能。研究人员当时的第一想法是,也许是细胞分泌某种物质帮了胰腺癌细胞大忙。
后来他们花了数年时间,试图找到那个关键的物质,但是一直无所获。就在僵持不下的时候,Straussman教授的学生,本研究的共同第一作者Leore Geller意外发现,在使用直径为0.45um过滤器过滤皮肤细胞的培养液之后,皮肤细胞培养液对胰腺癌细胞的保护作用丧失了。
这个神奇的现象让Geller意识到,助纣为虐的极有可能是细菌,因为0.45um的孔径足以过滤掉培养液中几乎所有细菌。结果他们真的在皮肤细胞中分离到一种类似细菌但不具有细胞壁的原核微生物——猪鼻支原体(Mycoplasma hyorhinis)。
当他们在皮肤细胞培养基中加适量的抗生素之后,神奇的保护作用也消失了。如果把猪鼻支原体注射到小鼠的肿瘤里,这个肿瘤就对吉西他滨产生了耐药性。
如此看来,极有可能是猪鼻支原体在作怪。但是猪鼻支原体究竟从哪里来的呢?让人气馁的是,研究人员发现,皮肤细胞中的猪鼻支原体实际上是因早期污染而进入皮肤组织内的。
「看到这个结果,我们真想把实验材料都扔了。」Straussman教授表示,「但是,我们后来还是决定跟随这个偶然的发现,继续前行。」[7]

2014年,比利时的研究团队曾经在他们的研究中发现,感染了猪鼻支原体的肿瘤组织培养物对吉西他滨不敏感[8],这可能与猪鼻支原体体内的胞嘧啶核苷脱氨酶(cytidine deaminase,CDD)有关。于是Straussman团队猜测,除了感染的猪鼻支原体,肿瘤内可能有其他可以产生CDD的细菌。
于是他们找到了一个叫KEGG的数据库[9],分析了2674种细菌的数据信息,发现11.4%的细菌携带有长链的CDD,44.4%的细菌携带有短链的CDD,剩下的细菌没有完整的CDD。其中,98.4%的含长链CCD的细菌属于γ-变形菌纲,例如大名鼎鼎的大肠杆菌和假单胞菌等。
经过进一步的分析,研究人员发现,具有长链CDD的细菌才具备让吉西他滨代谢失活的功能。于是他们用大肠杆菌进一步验证他们的发现。
结果在他们的意料之中,长链CDD缺失的大肠杆菌会失去代谢吉西他滨的能力,而补充长链的CDD后这种作用又可以重新恢复。同时研究人员还发现,吉西他滨只有进入到大肠杆菌体内,才能被代谢掉。这也直接解释了前面的滤液不起作用的原因。也证实了吉西他滨是被细菌吃掉了。而且他们还在小鼠模型体内证明了大肠杆菌的这种功能。
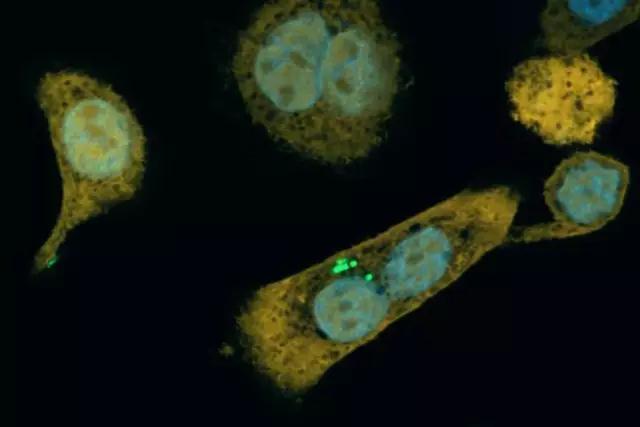
胰腺肿瘤内部的细菌
为了确定人体的胰腺肿瘤内是否确实有类似的细菌,研究人员检测了113个胰腺癌患者以及20个正常人的胰腺组织的细菌DNA、RNA以及脂多糖发现,76%(86/113)的胰腺癌细胞中存在细菌,而正常胰腺细胞中只有15%(3/20)存在细菌。而且在胰腺肿瘤里面的细菌,绝大部分属于γ-变形菌纲。即,它们都有「消化」吉西他滨的长链CDD。
当研究人员将从人体胰腺肿瘤中分离的15个菌株分别与癌细胞一起培养时,他们发现,其中14个菌株可以帮助癌细胞产生吉西他滨抗性。这也再次证明,人体胰腺癌肿瘤内也是有这种中和吉西他滨毒性的微生物的。
「这个研究的意义不仅仅在于胰腺癌,也不仅仅在于吉西他滨。」Straussman教授说,「我们之前对肿瘤内的细菌知之甚少,这个研究会扩大我们对肿瘤的认识。」
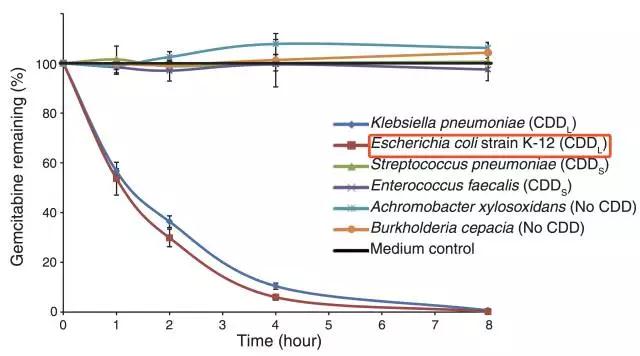
大肠杆菌K-12可在8小时内「吃掉」所有化疗药物
毕竟吉西他滨已被批准用于胰腺癌、非小细胞肺癌和乳腺癌等多种实体肿瘤的治疗,这些肿瘤也存在耐药性。而对于胰腺肿瘤内细菌的来源,研究人员表示有两种途径:第一,胰腺与肠道是相通的,所以原本寄居在肠道内的细菌,极有可能沿着胰腺分泌物的通道逆流而上,进入胰腺;第二,实际上细菌无时无刻不在通过口腔、肠道等部位进入我们的血液,大部分细菌都会被免疫细胞消灭掉,但是它们一旦进入肿瘤内,人体免疫系统也就拿它们没辙了[10]。
既然肿瘤的耐药性与细菌有关,而且研究表明,使用抗生素可以解除肿瘤的耐药性。那是不是意味着可以使用抗生素辅助治疗呢?在Straussman看来,直接使用抗生素不是一个好选择。抗生素无差别地杀伤所有细菌,会导致对人体有益的微生物也不幸被消灭掉。研究人员认为,最好的办法是开发靶向长链CDD的药物,只要让这个酶失活,化疗药物的活性就可以保持了。
大约在一个月前,来自上海交通大学医学院附属仁济医院消化科的房静远教授、陈萦晅副教授、洪洁和陈豪燕副研究员以及美国密西根大学邹伟平教授合作,在顶级期刊《细胞》上发表微生物导致肠癌耐药的重要研究成果,他们首次从证明具核梭杆菌(Fusobacterium nucleatum)可以通过调节癌细胞的自噬作用,促进结直肠癌对化疗的耐受[11]。
不过发现癌组织内的细菌可以让抗癌药物失活,还尚属首次。目前研究团队正在探索其他肿瘤内是不是也存在类似的细菌,以及它们对其他肿瘤耐药性的影响。
参考资料:
[1]Ravid Straussman et al,Potential role of intratumor bacteria in mediating tumor resistance to the chemotherapeutic drug gemcitabine.Science 357, 1156–1160 (2017)
[2] Lin QJ et al, Current status and progress of pancreatic cancer in China. World J Gastroenterol. 2015 Jul 14;21(26):7988-8003. doi:10.3748/wjg.v21.i26.7988. Review. PubMed PMID: 26185370; PubMed Central PMCID:PMC4499341.
[3] 戴月娣,张德祥,袁苏徐,陶莉.胰腺癌治疗方式评价及预后分析[J].中国癌症杂志,2011,21(03):211-215.
[4] 梁晨,王瑧,李影奕. 低表达miR-33a诱导胰腺癌细胞对吉西他滨的耐药[J]. 中国癌症杂志,2015,25(02):87-94.
[5]Straussman R et al, Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 2012 Jul 26;487(7408):500-4. doi: 10.1038/nature11183. PubMed PMID: 22763439; PubMed Central PMCID: PMC3711467.
[6]Wilson TR et al, Widespread potential for growth-factor-driven resistance to anticancer kinase inhibitors. Nature. 2012 Jul 26;487(7408):505-9. doi: 10.1038/nature11249. PubMed PMID: 22763448; PubMed Central PMCID: PMC3724525.
[7] https://wis-wander.weizmann.ac.il/life-sciences/how-bacteria-hinder-chemotherapy
[8]J. Vande Voorde et al.,Nucleoside-catabolizing Enzymes in Mycoplasma-infected Tumor Cell Cultures Compromise the Cytostatic Activity of the Anticancer Drug Gemcitabine. J. Biol. Chem. 289, 13054–13065 (2014).
[9]Kanehisa M, et al, KEGG: kyoto encyclopedia of genes and genomes. Nucleic Acids Res. 2000 Jan 1;28(1):27-30. PubMed PMID: 10592173; PubMed Central PMCID:PMC102409
[10]https://www.theatlantic.com/science/archive/2017/09/how-bacteria-could-protect-tumors-from-anticancer-drugs/539670/
[11]Yu T C, Guo F, Yu Y, et al. Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy[J]. Cell, 2017, 170(3): 548-563. e16.
From 奇点网


