Science:基因治疗时代的到来

医学史上有一些改变疾病治疗范式的大事件,比如外科手术的发明、抗生素的发现,而下一个大事件可能是正在成熟的基因治疗。
经过三十年的反复挫折,基因治疗终于迎来了曙光:在刚刚过去的2017年,美国FDA首次批准了两种针对血液疾病的CAR-T细胞免疫疗法和一种针对眼科遗传病的疗法Luxturna。
不久的将来,更多的基因治疗方法将从实验室走向临床,掀起一场新的医学革命,这两天在如火如荼的JP 摩根健康产业大会上,有诸多医疗公司在基因治疗领域跃跃欲试。
近日,美国《科学》杂志刊登了该领域6位知名科学家的联名文章“Gene therapy comes of age”,系统地回顾了基因疗法的发展史,并展望了基因疗法的未来。

基因治疗先驱西奥多·弗里德曼,图片来自ucsd.edu
早在45年前,基因治疗先驱西奥多·弗里德曼(Theodore Friedmann)就提出单基因遗传病可通过给病人提供正确的基因来治疗。从原理上来说,基于蛋白的疗法需要反复给药(例如糖尿病人需要一直注射胰岛素),而如果可修复病人的错误基因或直接提供正确的基因,那么单次治疗就有可能产生持续的治疗效果。
常见的几种基因疗法简介
经过近三十年的努力,科学家在基础研究方面取得了长足的进步。特别是新的基因载体、新的基因编辑技术以及在细胞生物学和免疫学领域取得的进展,为基因治疗的安全性和有效性提供了理论和工具支持。这些进步使得近十年来基因治疗的临床实验取得了很多突破性的进展。
传统的病毒载体
逆转录病毒和腺相关病毒(AAV)最有临床前景,我们的仅讨论这些载体。
(1)逆转录病毒载体
基因组包装信号的识别和产品细胞系的建立,为设计和生产能够进行反转录和DNA整合,同时缺乏复制潜力的载体,铺平了道路。二十世纪80年和90年代早期,证明开发的g型-逆转录病毒载体可以将基因导入再生的造血干细胞。C型-逆转录病毒可以将有效的基因导入原始T淋巴细胞。第一代的临床试验设计使用这些载体,转移一个特定的缺陷基因进入免疫缺陷病或癌症患者的T细胞或造血干细胞的基因组。
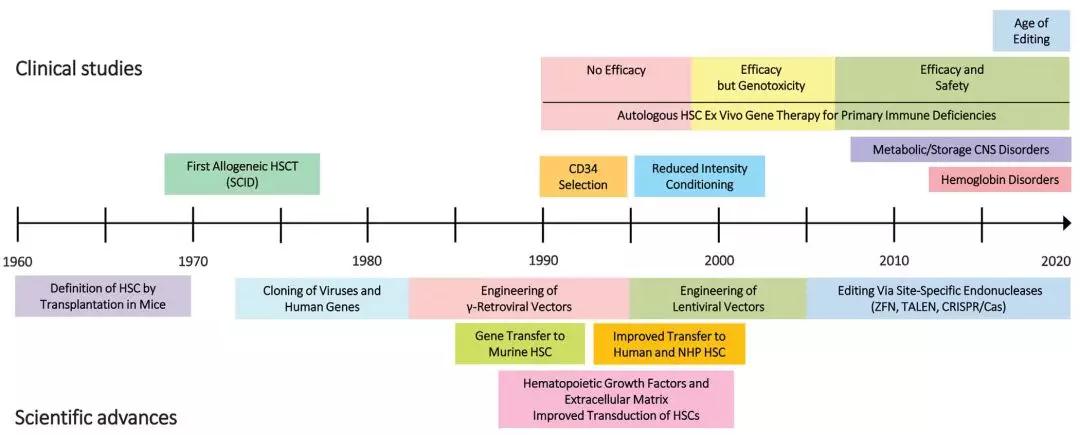
造血干细胞基因治疗的历史回顾。HSCT: 造血干细胞移植;HSC: 造血干细胞;SCID: 重症联合免疫缺陷;NHP:非人灵长类动物;ZFN:锌指核酸酶;TALEN: 转录激活因子样效应物核酸酶;CRISPR / Cas9:规律成簇间隔短回文重复序列(CRISPR)–CRISPR相关9(cas9)核酸酶。
随后,两个其他属的逆转录病毒加入到载体系列:慢病毒(lentiviruses)和泡沫病毒(spumaviruses)。与g型-逆转录病毒载体不同,慢病毒载体可以将基因导入处于不分裂的G0期的静止细胞。慢病毒载体可以携带更大更复杂的基因盒,因此,它们为血红蛋白病的治疗提供了重要进展。慢病毒载体和泡沫病毒载体的另一个优点,它们优先整合到基因的编码区。相比之下,g型-逆转录病毒载体,可以整合到基因5′-非翻译区,增加了造血细胞致癌基因插入突变的潜在风险。Lentiviruses载体是目前大多数造血干细胞应用的首选工具,但g-retroviral载体仍然是用于工程T细胞和造血干细胞基因治疗某些应用。使用“自我失活的SIN设计,去除慢病毒载体和g-retroviral载体的内源性强增强子元件,是降低遗传毒性的风险的另一种方法;目前大多数临床试验采用这种设计。对整合型逆转录病毒载体进行详细的综述。
(2)腺相关病毒(AAV)载体
AAV载体来自于一种非致病性,无包膜的细小病毒,天然具有复制缺陷。野生型AAV需要另一种病毒,如腺病毒或疱疹病毒,完成复制。AAV s病毒载体的所有编码序列可以由一个感兴趣的基因表达盒的替代。AAV载体的一个限制是,不能容纳超过5 kb的DNA(g-retroviral或慢病毒载体,可容纳>8 kb DNA)。AAV载体主要是非整合性型;转移的DNA作为游离基因是稳定。这一特点降低了整合风险,也限制了腺相关病毒载体在有丝分裂后细胞内的长期表达。
在20世纪90年代中期,两个研究小组证实,小鼠肌肉注射AAV载体后,转入的基因在小鼠体内长期表达。这一开创性的工作证实,在动物模型中,AAV载体可以有效地转染各种靶组织,包括肝脏、视网膜、心肌和中枢神经系统,具有特定的组织感染倾向,发现天然存在的AAV血清型和具有优化外壳的AAV工程型。综述改进AAV载体制造技术,增加AAV载体产量和产品纯度,大动物疾病模型上进行概念论证研究。上世纪90年代末,启动了开创性的AAV基因治疗B型血友病的临床试验,首先测试AAV载体肌肉注射,然后静脉注射,利用AAV2的肝脏倾向。这些早期的实验建立了安全的但剂量不足治疗,并出现抗AAV的免疫反应,最有可能的原因是,很多人携带了针对病毒衣壳的中和抗体和记忆性T细胞。如下面所述,充分利用AAV载体的治疗潜力,需要严格分析抗AAV免疫反应,包括针对一系列血清型AAV载体的细胞和体液反应。
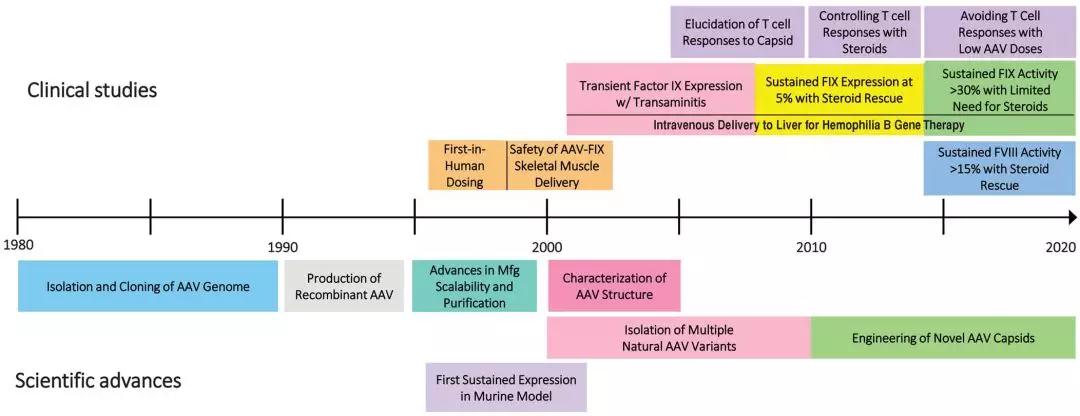
AAV基因治疗血友病的历史回顾。AAV:腺相关病毒载体;FVIII:VIII因子;FIX:IX因子;Mfg:制造业。
CAR疗法
工程T细胞正在成为强有力的癌症药物。嵌合抗原受体(Chimeric antigen receptors,CARs)是人工合成的基因工程受体,抗原,在一个单一的分子中整合了T淋巴细胞的特异性、功能和代谢。CAR由抗原结合结构域,来自于一个免疫球蛋白分子或一个T细胞受体,融合为一个细胞内信号转导结构域,介导激活和共刺激以增强T细胞功能和持久性。与抗原的生理受体不同,CARs可以被工程化设计,识别蛋白质和碳水化合物的糖脂,以及HLA多肽复合物。体外,CARs转染进入T细胞,从而产生可扩增的抗原特异性T细胞。激活内源性T细胞的主动免疫屏障和增加动力学。CAR-T细胞的生成需要稳定的基因转染,确保CAR在分裂和稳定的T细胞中持续表达。
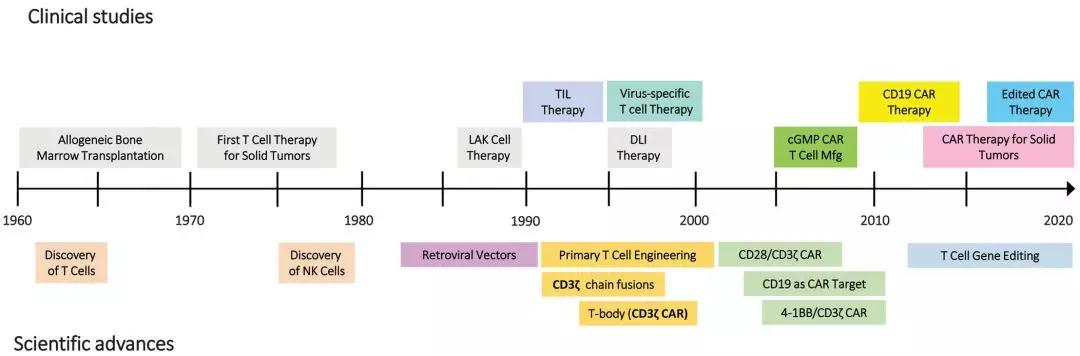
CAR-T细胞疗法的历史回顾。CAR:嵌合抗原受体;cGMP:现行良好制造规范;DLI: 供体白细胞输注;LAK: 淋巴因子激活的杀伤细胞;Mfg:制造业;NK:自然杀伤细胞;TIL:肿瘤浸润淋巴细胞。
基因组编辑
与传统病毒载体仅可以介导一种基因修饰(“基因添加”)不同,新的基因组编辑技术可以介导基因添加、基因删除、基因校正,以及细胞内其他高度靶向的基因组修饰。基因组编辑可以在体外细胞上进行,也可以在体内进行原位基因组编辑。
当前基因编辑技术使用的工具主要包括:锌指核酸酶(Zinc finger nucleases,ZFN)、转录激活样效应因子核酸酶(Transcription activator-like effector nucleases,TALEN)、归巢核酸内切酶(Meganucleases)和成簇间隔短回文重复系统(Clustered regularly interspaced short palindromic repeat,CRISPR)。这些工具能够有效地切割DNA序列,实现精确的基因组编辑。
使用ZFN、TALEN、归巢核酸内切酶等方法时,需要为每个DNA设计特定的核酸酶,这极大地限制了这些方法的应用。2012年,研究者Doudna和Char-pentier发现CRISPR-Cas9核酸酶组成的细菌防御系统,通过设计与目标位点互补的特定短向导RNA(gRNA),经过改造后可以切割目标DNA。CRISPR-Cas9核酸酶技术的编辑过程非常简便,使得它被迅速应用到哺乳动物细胞中。
基因组编辑技术对于治疗遗传性疾病具有很好的前景。对于肌肉萎缩疾病,前临床研究已经表明了基因编辑技术改变抗肌萎缩蛋白基因缺陷的能力。
但需要强调的是,基因编辑(特别是CRISPR-Cas核酸酶技术)仍处于实验和临床的初期阶段,仍存在一些潜在的可行性和安全性问题,可能会影响临床应用,这些问题还需要进一步的研究。
基因编辑进入临床的步伐越来越快。在血液疾病、肿瘤、遗传性的先天盲、神经肌肉疾病等方面已经看到了基因治疗的积极临床试验结果。工程化的ZFN已被用于帮助人类T细胞和造血干细胞抵抗HIV感染。TALEN已被用于制造可防止移植物抗宿主病(GVHD)的CAR-T细胞。在中国,监管机构已经批准了至少九个CRISPR-Cas核酸酶的试验,这些试验主要是为了敲除肿瘤T细胞中的PD1表达,据报道已有几个试验招募了患者。
基因治疗未来的展望
2017年是基因治疗正式走向临床的开始,可以看做基因治疗的元年。从今年开始,基因治疗将迎来更多的商业开发和临床实验。基因治疗可能是迄今为止人类开发的最复杂的“药物”,也有希望解决一些至今让医学界束手无策的疾病。
从过去三十年的经验和教训中,我们不难发现,基础研究的深度很大程度上决定了临床应用的成败。在大规模开展临床实验的时候,我们也不能忘记把目光重新放回基础研究。
相对于历史上的其它治疗方式,基因治疗还涉及伦理问题,特别是基因编辑可能被用于非治疗领域,引发了学界的担忧。基因治疗技术在进步的同时,也需要政策的跟进,以保证这种革命性的技术不被滥用。
From 基因治疗领域


